Lääkinnällisiä laitteita koskeva asetus (MDR)
EU:n asetus 2017/745

EU MDR vaatimukset
Fresenius Medical Care on sitoutunut varmistamaan, että kaikki lääkinnälliset laitteemme täyttävät lääkinnällisiä laitteita koskevan asetuksen (MDR) vaatimukset asetettujen siirtymäaikataulujen mukaisesti.
Lääkinnällisiä laitteita koskeva asetus (MDR) herättää monia kysymyksiä:
-
sen vaikutuksesta Fresenius Medical Caren tuotteiden saatavuuteen
-
sen soveltuvuudesta lääkinnällisten laitteidemme käyttäjille
Uuden lääkinnällisiä laitteita koskevan asetuksen (MDR) monimutkaisuuden ja laajuden vuoksi uudet vaatimukset tullaan panemaan täytäntöön erityisen toteutusohjelman mukaisesti. Tätä valvotaan tarkasti ylimmän johdon puolesta ja yhteistyössä ilmoitetun laitoksen kanssa (luettelo kaikista MDR:n mukaisista hyväksytyistä ilmoitetuista laitoksista löytyy sivun alaosassa olevien linkkien takaa*)
Seuraavasta kysymykset & vastaukset-osiosta löytyy olennaista tietoa lääkinnällisiä laitteita koskevan asetuksen (MDR) toimeenpanosta Fresenius Medical Carella ja sen vaikutuksista lääkinnällisten laitteidemme käyttäjille.
Kysymykset ja vastaukset
Täyttääkö Fresenius Medical Care lääkinnällisiä laitteita koskevan asetuksen (MDR) vaatimukset?
Ilmoitettu laitos arvioi vuonna 2019 Fresenius Medical Caren laatujärjestelmän sovellettavaan lääkinnällisiä laitteita koskevan asetuksen (MDR) vaatimuksiin ja vahvisti sen vaatimusten mukaiseksi. Sittemmin, Fresenius Medical Carelle tehdään säännöllisiä lääkinnällisiä laitteita koskevan asetuksen (MDR) vaatimusten mukaisia auditointitarkastuksia.
Yhtä lailla tärkeä edellys on tuotteiden todentaminen lääkinnällisiä laitteita koskevan asetuksen (MDR) vaatimustenmukaiseksi. Ilmoitetun laitoksen hyväksytyn arvioinnin jälkeen, ensimmäinen tuoteryhmä on sisällytetty lääkinnällisiä laitteita koskevan asetuksen (MDR) piiriin. Lääkinnällisiä laitteita koskevan asetuksen (MDR) vaatimustenmukaisten tuotteiden määrä kasvaa jatkuvasti seuraavien vuosien aikana, siirtymäaikasääntöjen mukaisesti.
Ilmoitetun laitoksen myöntämä lääkinnällisiä laitteita koskevan asetuksen (MDR) mukainen, vastaava EU-todistus päivitetään vastaavasti tuoteryhmien osalta.
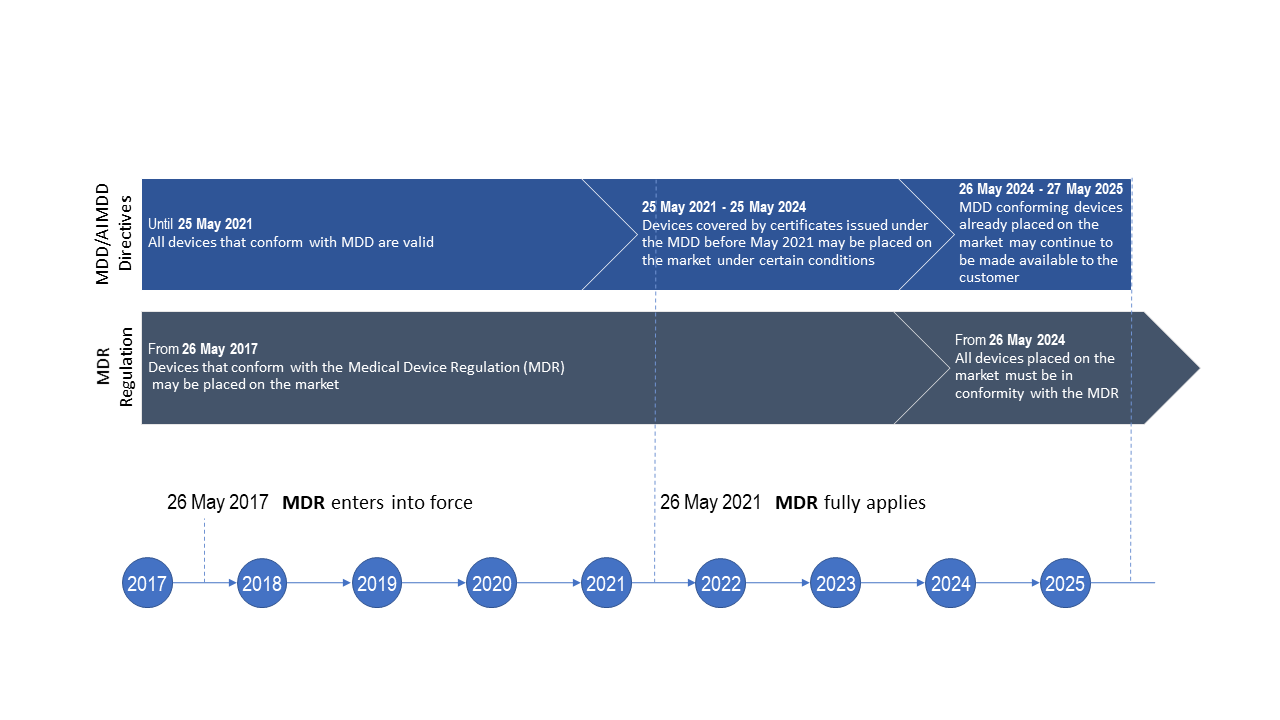
Lääkinnällisiä laitteita koskevan asetuksen (MDR EU 2017/745 ) siirtymäajat ottaen huomioon asetuksessa (EU) 2020/561 määritelty MDR-soveltamispäivän lykkääminen.
Lähde: EU:n komission muokattu infografiikka
Mitkä ovat Fresenius Medical Caren laitteiden siirtymäajat aikaisemmasta lääkintälaitedirektiivistä (MDD) lääkinnällisiä laitteita koskevaan asetukseen (MDR)?
Katso lääkinnällisiä laitteita koskevan asetuksen (MDR) siirtymäaikasäännösten yleiset aikataulut kuvasta.
Tiettyjen lääkinnällisten laitteiden riskiluokkiin voidaan soveltaa tiukempia aikatauluja sovellettavien säännösten mukaisesti.
EU:n komission voi katsoa tarpeelliseksi tarkistaa ja tarvittaessa muuttaa lääkinnällisiä laitteita koskevan asetuksen (MDR) aikatauluja. Esimerkkejä:
- COVID-19 kriisin vuoksi EU:n komissio on siirtänyt lääkinnällisiä laitteita koskevan asetuksen (MDR) soveltamispäivää vuodella eteenpäin, ollen 26.5.2021 (asetus EU 2020/561).
-
Tiettyjen Luokan I-tuotteiden sertifiointivelvotteiden siirtymäaikataulua on siirretty alun perin toukokuusta 2020 toukokuuhun 2024. Kyseisiä tuoteryhmiä ovat esim. lääkinnällisten laitteiden ohjelmistosovellukset, jotka tulevat uudelleen luokiteltavaksi (Oikaisu asetukseen (EU) 2017/745, alkaen 25.11.2019)
Milloin kaikki Fresenius Medical Caren tuotteet ovat uusien lääkinnällisiä laitteita koskevan asetuksen (MDR) mukaisia?
Lääkinnällisiä laitteitamme saatetaan EU:n markkinoille sovellettavien EU:n vaatimusten mukaisesti, laissa määritetyn siirtymäkauden aikana (entisestä MDD-direktiivistä MDR-asetukseen). MDD-direktiivin mukaisia sertifioituja tuotteita voidaan tietyin edellytyksin saattaa edelleen markkinoille toukokuuhun 2024 saakka, kunhan niiden CE-setifikaatit ovat voimassa.
Fresenius Medical Care vastaavasti tuo tänä aikana markkinoille sekä MDD-direktiivin että MDR-asetuksen mukaisia sertifioituja lääkinnällisiä laitteita ja Fresenius Medical Caren MDD-direktiivin mukaisesti seritfioidut tuotteet tullaan sertifioimaan MDR-asetuksen mukaiseksi toukokuuhun 2024 mennessä. Fresenius Medical Caren tuotevalikoimaan saatetaan tehdä muutoksia tässä vaiheessa.
MDD-direktiivin mukaisesti sertifioituja tuotteita voidaan myydä varastosta toukokuuhun 2025 saakka; nämä tuotteet korvautuvat MDR-asetuksen mukaisesti sertifioiduilla tuotteilla.
Mitä muutoksia tulee MDR-asetuksen mukaisesti sertifioitujen tuotteiden merkintöihin?
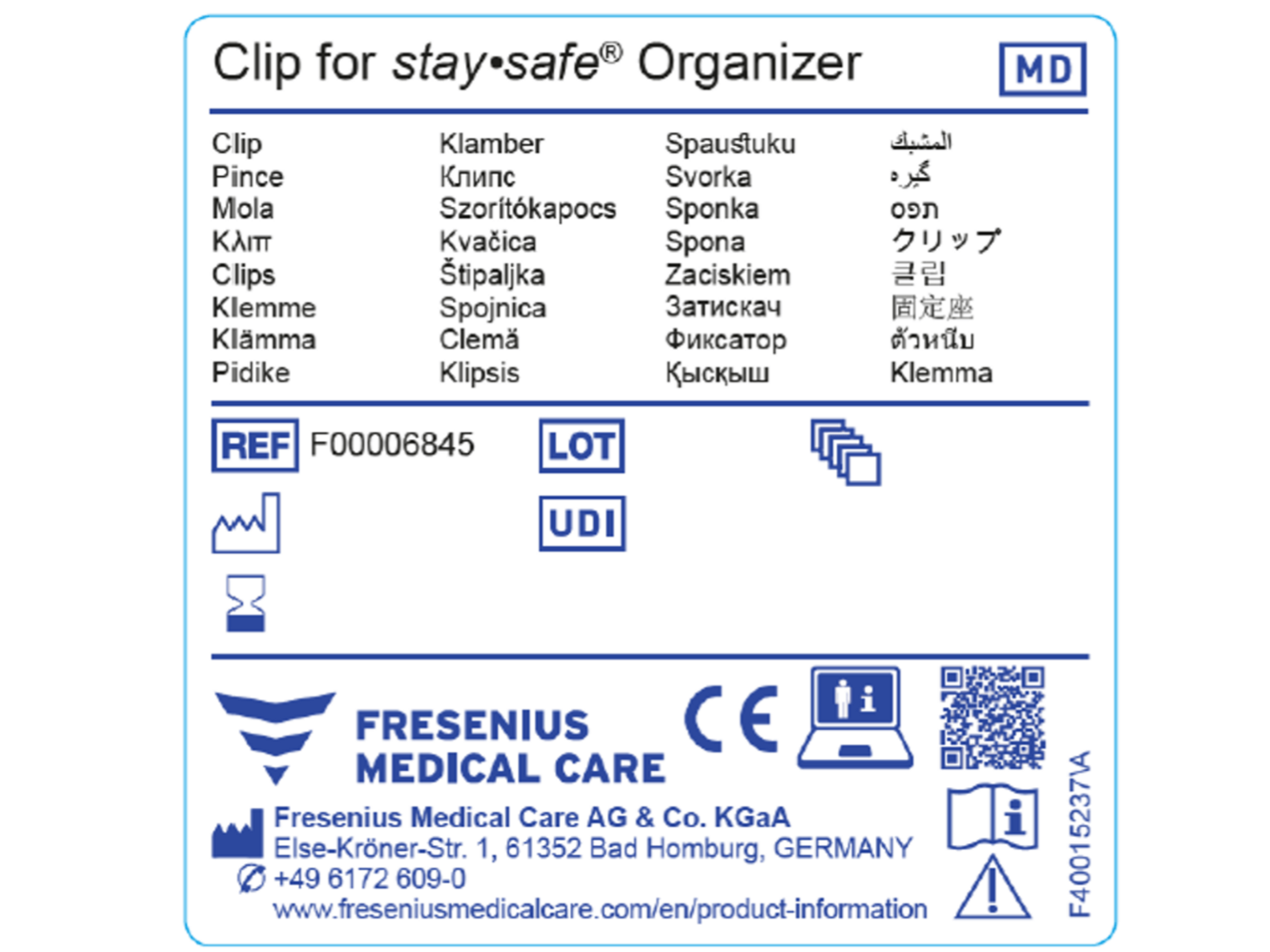
MDR-asetuksen mukaisesti sertifioiduilta tuotteilta edellytetään yksilöllistä laitetunnistetta (UDI, Unique Device Identifier). UDI on sarja numeerisia tai aakkosnumeerisia merkkejä, jonka perusteella tietty laite voidaan tunnistaa. MDR-asetuksen mukaan sertifioiduille tuotteille tarvitaan erityisiä symboleita, joista esimerkkejä löytyy ensimmäisestä kuvasta.
UDI-koodi ei korvaa MDR-asetuksen vaatimuksenmukaisten laitteiden tuotenumeroa; se on tarkoitettu tuotteen tunnistamiseen ja jäljitettävyyteen sen koko elinkaaren aikana*.
Katso esimerkki MDR-asetuksen mukaisesta geneerisestä etiketistä toisesta kuvasta.
Missä laajuudessa tulee asiakkaiden huolehtia Fresenius Medical Caren laitteiden ja tuotteiden jäljitettävyydestä UDI-merkintojä koskevan vaatimuksen käyttöönoton jälkeen?
MDR-asetuksen mukaisesti sertifioiduissa tuotteissa edellytetään yksilöllistä laitetunnistetta (UDI). UDI on sarja numeerisia tai aakkosnumeerisia merkkejä, jonka perusteella tietty laite voidaan tunnistaa. Asiakkaita koskevat velvoitteet on kuvattu EU komission lomakkeessa (linkki sivun alaosassa*), koskien
- Yksilöllistä laitetunnistetta (UDI)
- Valtuutettuja edustajia, jakelijoita ja maahantuojia
- Terveydenhuollon henkilökunta ja terveydenhuollon laitokset.
Mikä merkitys on EUDAMED-tietokannalla?
Eurooppalainen lääkinnällisten laitteiden tietokanta (EUDAMED) on EU komission hallinnoima tietokanta lääkinnällisten laitteiden tietojen tallentamiseksi.
EUDAMEDin tavoitteena on vahvistaa markkinavalvontaa tarjoamalla toimivaltaisille viranomaisille nopea pääsy valmistajia, valtuutettuja edustajia, lääkinnällisiä laitteita, sertifikaatteja tai tapahtumia koskeviin tietoihin kuin myös jakaa tietoa kliinisistä tutkimuksista ja myötävaikuttaa yhdenmukaiseen sääntelyn vaatimusten soveltamiseen, erityisesti koskien rekisteröintiin liittyviä vaatimuksia.
Kaikki valmistajat ja kaikki EU:n markkinoille saatettavat lääkinnälliset laitteet rekisteröidään EUDAMEDiin. Valmistajien (kuten Fresenius Medical Care) on varmistettava, että kaikki EUDAMEDille toimitetut tiedot ovat oikein ja ajantasaisia. Tiedot sisältävät tuotetietoja, erilaisia markkinavalvontaraportteja ja rekisteröityä talouden toimijaa koskevia tietoja.
Fresenius Medical Care on huolehdittava EUDAMEDin rekisteröintiä ja raportointia koskevien vaatimusten täyttäminen lakisääteisen aikataulun mukaisesti.
Lataa käyttöohjeet
MDR-asetuksen mukaisesti sertifioitujen Fresenius Medical Caren tuotteiden käyttöohjeet julkaistaan myös sähköisesti verkossa (painetun version lisäksi). MDR-asetuksen mukaisesti sertifioitujen tuotteiden käyttöohjeet löytyvät yrityksen englannin kielisiltä sivuilta. Pääset sivulle tästä linkistä.
MDR-asetuksen taustatietoa
EU:n komission tietoja ja lomakkeita
Seuraavat asiakirjat löytyvät nopeasti tästä:
- Regulation (EU) 2017/745 (MDR)
- General MDR information website by the EU Commission
- List of all MDR-designated Notified Bodies
Muut linkit:
- Overview on multiple factsheets and guides (see also below)
- Factsheets for Manufacturers of Medical Devices
- Factsheet UDI (as PDF)
- Factsheet for Healthcare Professionals and Health Institutions
- Factsheet for competent authorities in non-EU/EEA countries
Muista lähteistä saadut tiedot ja lomakkeet
Yhdistysten ja viranomaisten tietoa MDR-asetuksesta:
* EU:n komission lomakkeet UDI:lle, valtuutetuille edustajille/jakelijoille/maahantuojille ja terveydenhuollon henkilökunnalle